Jej celem jest wytworzenie cienkich mocno związanych z podłożem powłok metalowych, dla ochrony przed korozją, uzyskania pożądanych własności fizycznych lub w celach dekoracyjnych. Katodą w galwanostegii jest przedmiot obrabiany, a anodą płytka z czystego metalu przeznaczonego na powłokę, natomiast elektrolitem jest roztwór soli tego metalu. Galwanostegia głównie odróżnia się od galwanoplastyki tym, że wytworzona powłoka jest trwale związana z podłożem, a w galwanoplastyce powłoka oddzielona jest od powierzchni wyrobu.
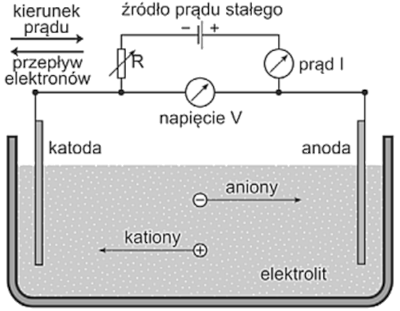
Podstawą działania galwanostegii jest wykorzystanie kilku zjawisk fizycznych. Rozpuszczone w wodzie sole, rozpadają się na jony dodatnie – kationy i jony ujemne – aniony, roztwór taki nazywany jest elektrolitem. Przepływ prądu stałego powoduje wydzielanie i przemieszczanie się dodatnich kationów na katodzie połączonej z ujemnym biegunem elektrycznym podczas, gdy ujemne aniony powstają na anodzie tj. biegunie dodatnim. Wszystkie jony metali są dodatnio naładowanymi kationami. Dlatego też przemieszczają się w elektrolicie w stronę katody i osadzają na powierzchni przedmiotu, podłączonego do bieguna ujemnego prądu stałego. Katodą jest przedmiot powlekany, a anodą płytka wykonywana z jak najbardziej czystego metalu pozbawionego domieszek innych pierwiastków. Odstępstwem od tej zasady są anody wykorzystywane w procesie chromowania. Używa się wówczas stopów ołowiu z dodatkiem od 7 do 9 % cyny. Drugi wyjątek, to powody ekonomiczne, wtedy niekiedy stosuje się złocone anody nierozpuszczalne, wytworzone z węgla, stali, albo platyny.